CAR-T疗法中常用慢病毒载体的冻干保护剂处方优化与稳定性研究
作者:AVT 2022.02.18 点击573次
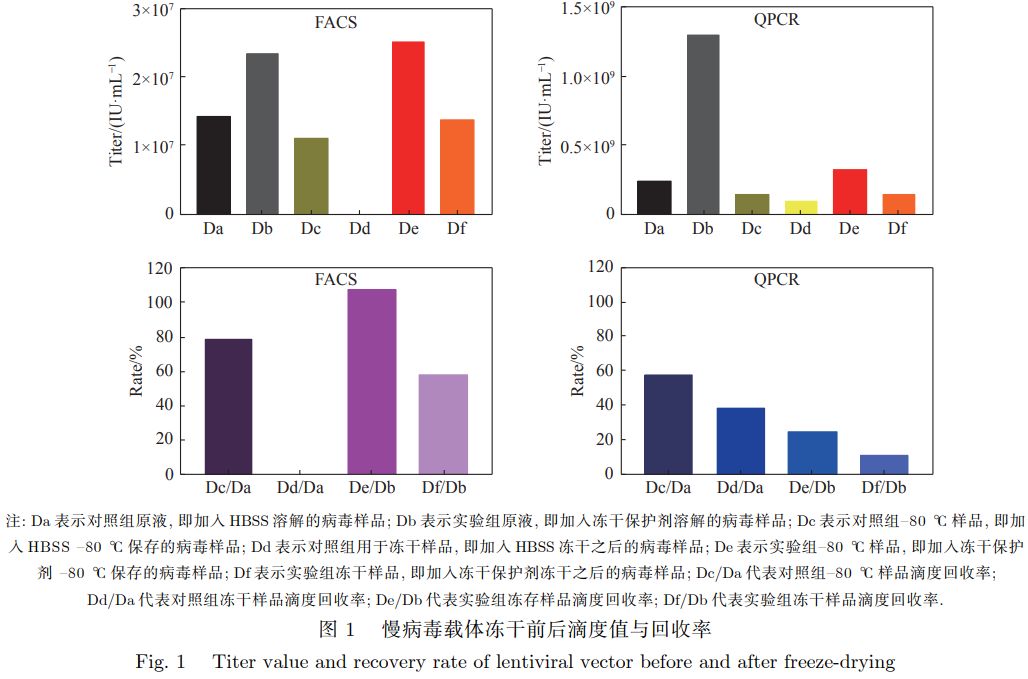
1.引言 1.1 CAR-T疗法 CAR-T(Chimeric Antigen Receptor T Cell Immunotherapy)指的是嵌合抗原受体T细胞疗法。可以简单理解为提取患者T细胞在体外进行基因工程改造,借助病毒载体将具有肿瘤细胞识别和T细胞激活能力的嵌合抗原受体整合到T细胞表面,从而精准杀伤肿瘤细胞的新型靶向肿瘤疗法,近年来通过优化改良在临床肿瘤治上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治方法。 1.2慢病毒载体(Lentiviral Vector, LV) 慢病毒载体(Lentiviral Vector, LV)是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治载体,对分裂细胞和非分裂细胞均具有感染能力,并可以在体内长期稳定表达。 慢病毒载体是CAR-T中最常使用的病毒载体,例如美国已经上市的两个靶向CD19的CAR-T药品,诺华的Kymriah和凯特的Yescarta,均采用慢病毒载体。国内申报IND并受理的细胞免疫治项目绝大部分也选用了慢病毒载体作为感染T细胞的载体。 CAR-T细胞生产环节中包括以携带目的基因的慢病毒载体感染T细胞,其中慢病毒的滴度对感染是否成功非常关键。 由于慢病毒载体由蛋白质和核酸组成,导致其储存条件遇到了与其他生物制品类似的局限性。比如通常无法在常温及4℃冷藏条件下长时间保存,热稳定性差,同时反复冻融也会降低其滴度。 目前尚无理想的慢病毒载体冻存保护液,-80℃冷冻保存或加入甘油保护剂也不能有效防止慢病毒载体在储存过程中滴度降低。此外慢病毒载体在运输时需要采用低温冷链运输,增加了运输成本,且无法规避运输带来的风险。 1.3冷冻干燥 冷冻干燥(Lyophilization)全称真空冷冻干燥,简称冻干,是在低温减压条件下,利用水的升华使制品低温脱水而达到干燥的一种技术。冻干在低温低氧条件下进行,多数生物反应停滞,且处理过程无液态水存在,使物料原有结构和形状得到最大程度的保护。通过冻干获得的粉体硬团聚少,粒径小且均匀,已经成为制备生物制品,尤其是蛋白多肽类粉针剂的一种重要方法。 2.研究目标 该研究旨在利用冻干技术,选取慢病毒载体,探索出适合病毒类载体储存的冻干保护剂型,同时制备得到新型的慢病毒载体冻干制剂,通过筛选慢病毒载体冻干保护剂处方,并以正交实验设计(DOE)的方法进行处方优化,制备得到外观良好、生物滴度高的慢病毒载体冻干制剂,使得该制剂在常温下具有较长的保质期,并且能够在高温高湿的条件下依然保持较高的生物活性。 3.研究结果 3.1慢病毒载体冻干制剂制备的可行性分析 使用流式细胞(FACS)和实时荧光定量核酸扩增检测(QPCR)的方法考察慢病毒载体的生物滴度,实验结果如图1所示。
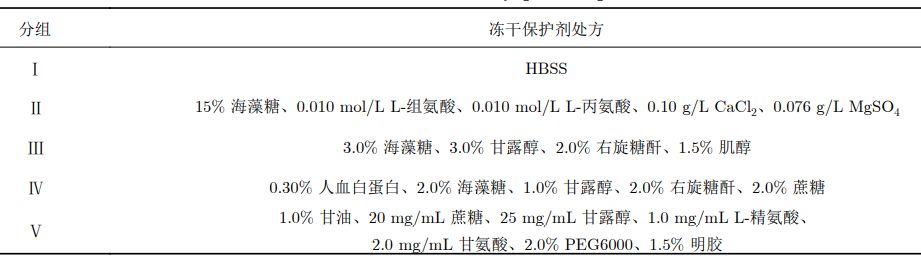
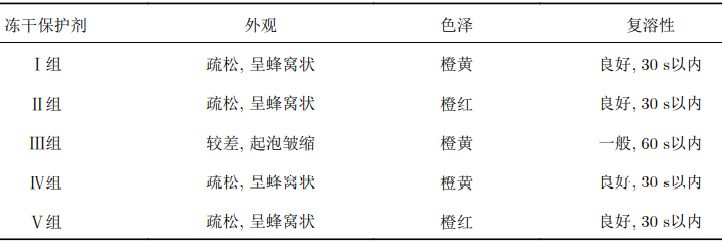
比较冻干保护剂与HBSS对于慢病毒载体在–80 ℃ 冻存以及冻干过程中的影响,同时对比冻存前后以及冻干前后对慢病毒滴度的影响,实验结果表明,在冻干的过程中,冻干保护剂确实能够起到保护作用,最终两种检测方法均测得滴度回收率。通过这两种检测方法可以看出慢病毒载体冻干制剂制备具有可行性。 3.2慢病毒载体冻干保护剂处方的筛选 为筛选适用于慢病毒载体的冻干保护剂处方,从菌种冻干、脂质体冻干、蛋白质冻干(包括减毒活疫苗类)、其他病毒类冻干(腺病毒等)选定了5组基本的冻干保护剂(含1组对照组)进行研究分析: 采用以上5组处方进行慢病毒载体冻干保护剂处方筛选,以冻干产品的外观、色泽和复溶性为指标综合评价其理化性质,考察了各种冻干保护剂对冻干产品的保护作用,结果见下表:
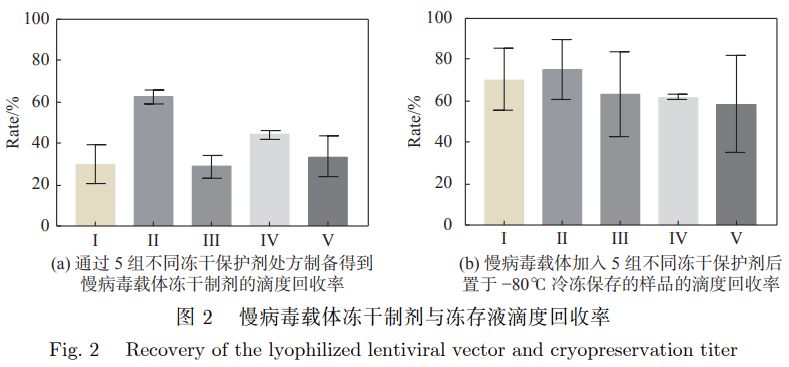
5组冻干保护剂处方的慢病毒载体滴度回收率结果如图2所示。
从图2(a)中可以看出,Ⅱ组的冻干保护剂处方保护效果最佳,加入Ⅱ组的冻干保护剂处方后制备得到的慢病毒载体冻干制剂,感染细胞后通过QPCR的方法检测得到的滴度值最高;图2(b)显示,Ⅱ组慢病毒载体的滴度回收率最佳,两图相符合,无论在冷冻保存条件下还是在真空冷冻干燥后,Ⅱ组的冻干保护剂的效果均最好,所以选择以Ⅱ组保护剂为基础进行优化。根据多响应预测结果,确定最优的冻干保护剂处方为15g海藻糖、8.9mg L-丙氨酸、15.5mg L-组氨酸、1.0 mg CaCl2、0.76 mg MgSO4。 3.3慢病毒载体冻干制剂稳定性研究 使用QPCR检测慢病毒载体冻干制剂和冻存制品的生物滴度 (IU/mL),对生物滴度值取lg 对数函数,以lgT对时间t做图,结果可参见图4。
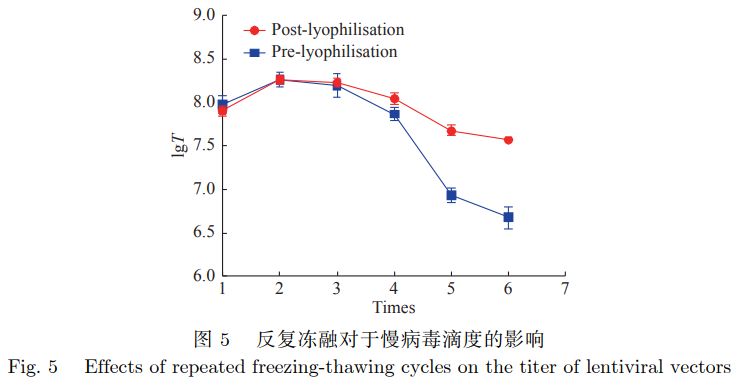
结果表明,慢病毒载体在冷冻干燥以后可以实现较长时间的保存,但是生物滴度值会下降,说明在储存时也会缓慢失活。但是在4 ℃及23℃保存的条件下慢病毒载体冻干制剂均更加稳定(图4a及图4c),凸显了其储存优势。 使用QPCR检测慢病毒载体冻干制剂和冻存制品反复冻融后的生物滴度(IU/mL),结果可参见图5。
可以看出反复冻融对于慢病毒载体冻干制剂的影响并不明显,随着反复冻融次数的增加,慢病毒滴度能维持稳定;然而对于慢病毒载体冻存制剂而言,反复冻融的影响显著,表明慢病毒冻干制剂在反复冻融的条件下更加稳定,可以实现反复冻融5~6次,显著改善了液体制剂反复冻融导致的活性损失等问题。 4.讨论与总结 4.1冻干保护剂的选择 冻干保护剂主要可分为以下几类:一般为多羟基化合物、糖类、氨基酸、蛋白质、聚合物和无机盐等化合物。因为冻干保护剂不但要具有保护生物制品活性的效果和结构不发生改变,而且要具有冻干赋形的作用。 糖是一种使用最广泛的冻干保护剂,本研究中采用的海藻糖属于二糖,比蔗糖具有更低的吸湿性和更高的玻璃态转化温度,其羟基能替代水分子与蛋白质分子表面部分结合,而且海藻糖分子较小,能填充到蛋白质分子的空隙中,有效地限制蛋白质分子内部的结构发生变化,在冻干时可以对慢病毒的蛋白衣壳形成保护,因此冻干制剂保护效果更好。 此外,需要指出的是,某些糖类辅料可能降解,对蛋白稳定性造成不利影响。例如,蔗糖会水解成葡萄糖和果糖,形成还原糖,从而导致赖氨酸残基的蛋白糖化。据报道,这些糖化反应甚至在冻干蛋白制剂的储存过程中以固态发生。相比之下,不具有还原性、高玻璃化转变温度、高酸碱稳定性、天然双糖中最稳定的海藻糖,作为保护剂正获得越来越广泛的应用。 氨基酸具有酸性羧基和碱性氨基,能够调节制品溶剂环境的pH值,不同类别的氨基酸具有不同的亲水性功能,而亲水性强的氨基酸较易与蛋白质产生氢键,这对蛋白质在冻干的过程中的稳定性和活性具有重要的保护作用,如组氨酸、丙氨酸等,可以增加慢病毒载体包膜蛋白和组氨酸磷酸盐缓冲液间的张力,提高慢病毒载体包膜蛋白水化水平。而加入二价阳离子类,如CaCl2和MgSO4这两种无机盐,可延迟海藻糖结晶,通过和磷酸根阴离子存在下氢键网络以及分子迁移率的变化抑制结晶。 4.2总结 该研究给出了一种新型的慢病毒载体冻干制剂的制备方法。通过研究冻干保护剂的组分筛选与优化、冻干产品的制剂学研究和稳定性研究,表明冻干技术对于慢病毒载体的储存带来了新的突破。 在最优冻干保护剂处方的条件下,慢病毒载体冻干制剂能够实现储存时间长、运输过程简便、稳定性提高的优点,为CAR-T细胞免疫治的进一步推广提供了技术基础。 这其中,作为冻干保护剂主要成分的海藻糖发挥着不可替代的作用,提示海藻糖作为一种新兴的冻干保护剂具有广阔的应用前景与市场价值。 本文来自:AVT | 产品分类
重点推荐产品
|
 |