凡人修炼脂质体秘籍2
作者:AVT 2021.11.09 点击621次
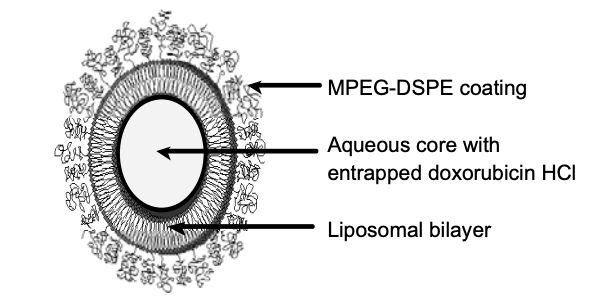
诗云:熟读唐诗三百首,不会作诗也能编。 笑看处方无数篇,凡人修炼上青天。 脂质体为脂质微囊,由单个两性(如磷脂)双分子层包裹一个和/或多个两性双分子层分隔一系列同心不连续的水性隔室构成。在脂质体药品中,药物是包合在脂质体内部的。一般水溶性药物包含在水性隔室中,亲脂性药物则包含在脂质体的脂质双分子层中。药物从脂质体制剂中的释放将随聚乙二醇和/或胆固醇或其它潜在脂质体添加剂的加入而发生改变。脂质体制剂不同于乳剂,微乳和药物脂质复合物。 脂质体的处方设计受药物油水分配系数、离子电性等理化性质的影响很大。油水分配系数可用来预测药物在溶媒中的溶解度和药物动力学特征,为剂型设计提供理论依据。一般脂溶性药物的lgP大于4.5,而水溶性药物的lgP小于0.3,当药物与磷脂分子层电荷性质相同时,不易包封,通过在脂质体制备过程中添加适当辅料,使其成为与包封药物电荷相反的脂质体,可改善药物包封率低的问题。有些药物可以进行结构修饰,改善药物的亲水、疏水特性,提高药物包封率。 粒径是脂质体处方设计的重要评价指标,其大小和分散均匀程度直接影响脂质体的体内行为。大粒径脂质体易被巨噬细胞内吞而集中分布于肝脏,较小粒径的脂质体能够延长药物在体循环时间,起长效作用。粒径低于50nm时,脂质体可透过肝内皮进入脾、骨髓和肿瘤组织。脂质体粒径增至1-12μm时,易被肺部摄取。 上一篇凡人修炼脂质体秘籍----传承篇,已讲述了脂质体的很多前人留下的文献参考资料。本篇处方篇主要分享脂质体处方的依据和国内外脂质体处方实例,已便于大家更好的了解脂质体处方。 1. 官方发布的指南文章对脂质体处方要求 1.1国外有2015年 FDA Liposome Drug Products脂质体药物制药工业指南草案。 对处方要求如下: 处方中所用脂质的表达方式为与原料药的相对摩尔比和质量百分数。处方中原料药用量的表现形式对于液体制剂而言,我们建议将制剂中原料含量的表达为:每毫升药品(也可以为每瓶药品中)中含有的原料药毫克数。对于干粉,则只需列出原料药的总质量。 下列信息通常可用于确定脂质体的处方。下面所列举的特性能导致脂质体药品表现的改变,包括药物成分的泄漏。根据以下指标,不同脂质体药品所适用的特性可有所不同。 a. 脂质体的形态学,如适用,包括层状结构的确定 b. 表面特征,如适用 c. 脂质体的结构和完整性,这涉及脂质体药品处方包载预期的药物量和持续包载药物的能力 d. 净电荷,一般以脂质体 Zeta 电位的形式度量 e. 药品的粘度 f. 含药指标,例如,药物包封率(定义为包封在脂质体内部的药量与总药量的比值)和脂质体载药率(定义为含药量与脂质量的百分比,也就是药物-脂质的比例)。 g. 粒径(即平均粒径和分布情况),如在微粒密度已知的条件下,优先在质量或体积的基础上确定。 h. 转相温度 i. 在声明/描述的实验条件下,进行脂质体药品的体外释放试验,包括实验条件选择的支持性数据和相关的资料。 j. 整个有效期内的脂质体泄漏率 k. 盐浓度变化引起的脂质体完整性改变(如,药物释放,载药率和脂质体大小) l. 支持目标脂质体结构的光谱数据(磷核磁共振) 1.2国内在 2020-11-30 颁布了盐酸多柔比星脂质体注射液仿制药研究技术指导原则(试行)。 仿制药的处方应与参比制剂一致,辅料种类和用量通常应与参比制剂相同。 氢化大豆磷脂酰胆碱(HSPC)、胆固醇、甲氧基聚乙二醇磷脂酰乙醇胺(MPEG-DSPE)是本品的关键成分,应按相关要求进行登记和关联,或由制剂注册申请人一并提供研究资料。仿制药应与参比制剂选择相同来源(天然的或合成的)的脂质辅料,制定严格的内控标准,并提供研究资料证明仿制药所采用的脂质辅料与参比制剂中的脂质辅料相似(如,各组分比例)。 1.3中国药审中心:2005年10月20日细胞毒类抗肿瘤药脂质体制剂专题会会议纪要 。对于脂质体制备所用关键辅料磷脂加强了质量控制。 1.4中国药审中心关于脂质体、乳剂注册申报注意事项文章:审评三部 张宁 注册分类五中的特殊情况。 对处方工艺筛选的要求:对于制剂而言,处方工艺筛选是整个研究过程中的前期工作和重点工作,建议申办者能提供详尽的处方工艺筛选过程,并附有翔实的试验数据和结果分析。如上资料,从申报者的角度考虑,是对最终确定的处方工艺的合理性进行充分的阐述,从审评者的角度考虑,这是评价的基础。其中,需提醒重点关注的是关于灭菌工艺的选择和验证,如上制剂由于辅料的不稳定性(例如磷脂易氧化降解)、剂型的不稳定性(例如乳剂的分层问题)等,导致灭菌工艺的选择比较困难,故提请申办单位对最终选择的灭菌工艺进行验证,证明所用灭菌工艺既能保证产品达到无菌效果,又不影响产品质量。 1.5中国药审中心2004年11月11日两个肿瘤药物脂质体品种的专家咨询会。 对处方工艺筛选的要求:尽管早在60年代初,国外就开始了脂质体的研究,但目前真正上市的脂质体并不多,国内现脂质体放大生产的成熟度尚不够。脂质体剂型对制备条件的变化很敏感,为了保证最终顺利过渡到大生产,打好坚实的研究基础是很有必要的。在处方工艺的筛选过程中,筛选指标应全面,需综合考虑包封率、渗漏率、粒径、稳定性(包括产品的稳定性和脂质材料的稳定性)等因素。对于关键的工艺条件和工艺步骤应进行验证,说明工艺的合理性和重现性。对所用的工艺设备应给予明确说明,并对放大生产的可行性进行论证。 1.6 CFDA 发布《药物注射剂研发技术指导意见》征求意见稿2018年 对处方要求:注射剂所采用的原料药、辅料、包装容器/材料须符合供注射用的质量要求,并进行登记、公示,与制剂共同审评。对于原料、辅料、包装容器/材料应建立完善的质量保证体系,在杂质(包括元素杂质等)、微生物限度、热原/细菌内毒素等方面应建立严格的控制措施和标准。药物和辅料、包材的相容性应符合要求。对于仿制药应尽量按照与参比制剂一致的原则选择原料药、辅料,通过质量源于设计的原理进行处方、工艺研究;对特殊类型注射剂,需客观的、有针对性的评价原料、辅料和包装材料间的相容性,并结合工艺过程确认辅料的性质对制剂特性的影响。注射剂中应对抑菌剂的使用严格控制,原则上不建议使用抑菌剂。必须加入抑菌剂的注射剂,应建立抑菌剂的质量要求,并按照中国药典现行版要求提供抑菌效力验证结果及安全性的综合评价。除另有规定外,静脉注射、鞘内注射、硬膜外注射等注射剂,不得添加抑菌剂。 2. 药剂书中的详细脂质体处方 先在药剂书上了解脂质体处方。liposome入门的书籍比如邓英杰主编,《脂质体技术》,《脂质体(原著第二版)》,由邓意辉主译和《liposome technology(The third edition)》等书。多看书,有惊喜,比如这本《现代给药系统的理论和实践第2版》,书中有多个国外上市脂质体和类似产品详细处方工艺可以参考。 例如这几个: 2.1 DaunoXome,盐酸柔红霉素脂质体浓缩液,处方:主药53.46mg(相当于柔红霉素50mg);DSPC 753mg;Chol 180mg (DSPC/Chol=2/1,mol);Citrate Acid 7mg;Sucrose 2125mg;甘氨酸 94mg;CaCl2 7mg;适量的HCl,NaOH调节pH。制备方法:主动载药法,包封主药50mg,规格:25mL,粒径:45nm;pH4.5~6.5;2~8度保质期6月。 2.2 Ambiso冻干品: 处方:Amb 50mg;HSPC 213mg;Chol 52mg(HSPC/Chol=2/1,mol);DSPG 84mg; a-VitE 640mg;Sucrose 1g;六水琥珀酸二钠 30mg。无菌条件下过5μm微孔滤膜,静脉滴注30~60min,6h用完。2~8度保质期2.5年;粒径100nm。 2.3 Abelcet为Amb的磷脂复合物,处方DMPC/DMPG=7/3,35%molAmb,形成长度大于1.5μm的结构。 2.4 Amphocil为胶态分散系统,处方为mol比为1/1的Amb/胆固醇,粒径120nm。 2.5 Alveofact 是一种治疗ARDS的肺表面活性剂,DPPC80%,PG11%,PE4%,微量的鞘磷脂(sphingomyelin),PS,PI等,规格50mg/1.2mL,粒径0.3~0.4μm。 2.6 Pevaryl-lipogel 皮肤用凝胶剂,益康唑10mg/1g凝胶,注入法制备:药物和脂质的乙醇溶液注入到50倍体积的水相中,再匀化,粒径:170nm,包封率>95%,保质期2年。 2.7 HeparinPur 肝素脂质体:10%EPC(PC含量>90%)+16%乙醇(w/w),规格:肝素30000/25g或 60000I.E./25g,注入法制备,自缓冲系统,pH6.5,保质期:3年,粒径:130~170nm,是一种喷雾凝胶剂,喷到皮肤上,乙醇挥发,形成凝胶。 3.专利中脂质体处方举例 3.1伊立替康或盐酸伊立替康脂质体及其制备方法 申请(专利)号:CN201310028546.3,CN103120645A脂质体含有伊立替康或盐酸伊立替康,中性磷脂以及胆固醇,胆固醇与中性磷脂的重量比例为1:3-5其通过离子梯度法制备得到。 3.2重酒石酸长春瑞滨脂质体及其冻干粉针与制备方法 CN200610001318.7,CN100438855C含有以下成分:重酒石酸长春瑞滨,磷脂,胆固醇,维生素E,它们之间的重量比为1份:5-100份:1-15份:0.01-0.05份。 3.3卡铂前体脂质体注射剂及其制造方法 CN 02100554,CN 1435167 A卡铂前体脂质体注射剂,由下列重量份数比的成分组成:卡铂,4000-12000;磷脂,500-1000;胆固醇,50-100;氯化钠,9000;冻干保护剂100-1000;有机溶剂500-700;蒸馏水1000。生产卡铂前体脂质体注射剂的方法,步骤: 1) 置备上述重量及体积份数比的原料; 2)将卡铂溶解于蒸馏水中,加入氯化钠,得到与血浆等渗的卡铂水溶液; 3)将磷脂和胆固醇用有机溶剂溶解,并高速注入到上述卡铂水溶液中; 4)挥发除净有机溶剂; 5)加入冻干保护剂,搅拌; 6)真空冷冻干燥得到粉末状的固体。 4.国内脂质体处方研发报道: 4.1齐多夫定硬脂酸酯脂质体制备及处方设计与优化,Journal.9med.net作者:王秀敏 采用乙醇注入法制备。工艺处方:大豆磷脂质量浓度为50g/L,大豆磷脂与胆固醇的质量比为5:1,大豆磷脂与齐多夫定硬脂酸酯的质量比为20:1,水相是10%的海藻糖溶液。 4.2均匀设计法优化塔斯品碱脂质体处方,万方,作者:卢闻 薄膜挤压法制备,根据均匀实验设计,以外观、脂质体粒径、复溶情况及包封率为指标综合评价。处方为:蛋黄卵磷脂与胆固醇摩尔比50:50;水合介质用量10mL;冻干保护剂选用蔗糖,用量为13%,平均粒径为186.4nm,包封率为(88.29±4.2)%。 4.3西罗莫司脂质体的制备及处方因素考察,维普期刊专业版,作者:王晓宇 乙醇注入法制备,微柱离心-HPLC法测定包封率,以包封率为评价指标,考察磷脂浓度、磷脂胆固醇质量比、药脂比、水相介质pH等因素对脂质体的影响,在此基础上运用正交设计对处方进行优化。结果正交试验结果表明磷脂浓度为4%,磷脂与胆固醇质量比例为8:1,药物磷脂质量比为1:20,水相pH为7.4为最佳处方,制得的脂质体包封率为(82.11±2.13)%。 4.4应用均匀设计法对灯盏花素纳米脂质体的处方优化,维普网 ,作者:田维维 薄膜挤压法制备,按均匀设计法,以包封率和载药量为考察指标,对实验结果进行最优子集法的二次回归优选处方配比。结果:用胆固醇和卵磷脂来包封的包封率为69.60%,载药量为29.06%,平均粒径为105.6 nm。 4.5优福定脂质体的处方与工艺优化,维普期刊专业版,作者:宋力 薄膜分散-冷冻干燥法制备,以主药替加氟和尿嘧啶包封率为指标,优化处方为磷脂与药物的重量比16:1,磷脂与胆固醇的重量比7:1,pH 5.6的磷酸盐缓冲液为水合递质,水化温度为40℃。替加氟和尿嘧啶的平均包封率分别为(46.6±2.01)%、(48.7±1.49)%;脂质体的体外释放符合一级动力学方程,具有缓释作用。 4.6正交设计优化猕猴桃根多糖脂质体的处方工艺,作者:丁美红 逆向蒸发法制备。最佳工艺为搅拌时间2.5min、APPS/卵磷脂为1:20、胆固醇/卵磷脂为1:0.25、PEG/卵磷脂为1∶0.15。所得的脂质体平均包封率为70.16%,稳定系数为0.0597。 4.7星点设计-效应面法优化叶黄素脂质体的处方及制备工艺,万方医学,作者:李传灵 以包封率、粒径和渗漏率为自变量,叶黄素用量,大豆卵磷脂与胆固醇质量比,旋蒸温度为因变量,利用星点设计模型进行二项式拟合,通过三维效应面图和等高线图选择最佳处方,并对预测结果进行验证。最佳处方和工艺为叶黄素用量5.34 mg,大豆卵磷脂与胆固醇质量比为14.35:1,旋蒸温度为32.9℃。在该条件下,3批叶黄素脂质体样品的平均包封率为(87.49±0.33)%,粒径为(68.52±0.21) nm,渗漏率为(14.54±0.50)%。 4.8多西紫杉醇脂质体制备工艺及处方优化研究,万方医学,作者:黄红兵 最佳处方工艺为:药物:(磷脂+胆固醇)为1:20;磷脂:胆固醇为6:1,水合介质为磷酸盐缓冲液(pH=7.4),制备浓度为0.5mg/ml,采用薄膜-超声分散工艺制备,高压乳匀次数为6次。按该工艺制备3批含药脂质体,包封率最高可达84.4%±1.6,平均粒径为(147.1±41.1)nm,Zeta电位为+(2.25±0.2);在室温条件下放置14d和在4℃下放置180d,各项指标变化不显著;体外释放实验显示,含药脂质体具有明显缓释特性。 5.美国一些上市的脂质体处方汇总 不同于国内的脂质体说明书,只列出辅料名称,比如国内生产的注射用紫杉醇脂质体处方为卵磷脂,胆固醇,苏氨酸,葡萄糖。国外上市的注射剂产品说明一般有详细的处方,包括辅料的具体用量。 5.1. ARIKAYCE阿米卡星脂质体吸入混悬液 每瓶含硫酸阿米卡星623 mg/8.4 mL, pH值范围为6.1至7.1,脂质与阿米卡星的重量比范围为0.60至0.79。非活性成分包括胆固醇、DPPC、氯化钠、氢氧化钠(用于pH调节)和注射用水。 5.2.EXPAREL布比卡因脂质体注射液 采用DepoFoam®技术。脂质体颗粒的直径范围为24至31μm。脂质体悬浮在0.9%氯化钠溶液中。每小瓶含有标称浓度为13.3 mg/mL的布比卡因。非活性成分为:胆固醇,4.7 mg/mL;(DPPG),0.9 mg/mL;三辛酸甘油酯,2.0 mg/mL;和DEPC,8.2 mg/mL。pH值在5.8至7.4之间。 5.3. DepoCyt®阿糖胞苷脂质体注射液 采用DepoFoam®技术。每瓶含有50毫克阿糖胞苷。以0.9%w/v的氯化钠和注射用水配制而成。阿糖胞苷浓度为10 mg/mL。非活性成分为胆固醇,4.4 mg/mL;三油酸甘油酯,1.2mg/mL;DOPC,5.7 mg/mL;和DPPG,1.0 mg/mL。pH值在5.5到8.5之间。 5.4.DepoDur®硫酸吗啡缓释脂质体注射液 采用DepoFoam®技术。脂质体的直径在17至23μm的范围内。脂质体悬浮在0.9%氯化钠溶液中。每瓶含有10 mg/mL的硫酸吗啡(以五水合物计)。非活性成分为:DOPC,4.2 mg/mL;胆固醇,3.3 mg/mL;DPPG,0.9 mg/mL;三油酸甘油酯,0.3 mg/mL; pH值在5.0到8.0之间。 5.5.DOXIL® 盐酸阿霉素脂质体注射液 装在10毫升或30毫升玻璃瓶中,一次性使用。每瓶含有20毫克或50毫克盐酸阿霉素,浓度为2 mg/mL,pH值为6.5。隐形脂质体载体由胆固醇组成,3.19mg/mL;HSPC,9.58 mg/mL;和MPEG-DSPE,3.19 mg/mL。每毫升还含有约0.6 mg的硫酸铵,组氨酸作为缓冲液;调节pH的盐酸和/或氢氧化钠;蔗糖(调等渗)。超过90%的药物被包裹在隐形脂质体中。 5.6.ONIVYDE伊立替康脂质体注射液 每10 mL含有43 mg伊立替康游离碱,浓度为4.3 mg/mL。脂质体是一个单层脂质双层囊泡,直径约110 nm。脂质体由DSPC 6.81 mg/mL,胆固醇2.22 mg/mL组成,和MPEG-2000-DSPE 0.12 mg/mL。每mL还含有HEPES作为缓冲液4.05 mg/mL和氯化钠作为等渗试剂8.42 mg/mL。 5.7.AmBisome注射用两性霉素B脂质体 每瓶含50 mg两性霉素B, 213 mg氢化大豆磷脂酰胆碱,52mg胆固醇,84mg DSPG,0.64mg α-生育酚, 900mg蔗糖,以27mg六水合琥珀酸二钠为缓冲液。pH值为5-6。脂质体直径小于100nm。 综合以上,脂质体药物一般由主药成分和脂质成分组成。脂质成分包封药物并作为递送的载体。脂质成分的性质和用量是确保产品安全性、稳定性和有效率的关键因素。在脂质体处方中,磷脂,胆固醇等辅料有非常重要的作用,对于辅料的详细论述请关注凡人修炼脂质体秘籍3----辅料总览篇(即将发布)。脂质体处方复杂,所以在脂质体产业化开发过程中,宜运用QbD 理念进行脂质体研发的具体过程,应以脂质体层数和形状、粒径和粒度分布、脂质组成和浓度、包封率等指标,制定严谨的控制策略以获得稳定均一的产品。 参考文献: 1.《现代给药系统的理论和实践 第2版》作者:(德)Rainer H.Muller,(德)Gesine E Hildebrand著;胡晋红主译 出版:北京:人民军医出版社,2004年 2.2015年 FDA Liposome Drug Products脂质体药物制药工业指南草案 3.中国药审中心:2005年10月20日细胞毒类抗肿瘤药脂质体制剂专题会会议纪要 4.中国药审中心关于脂质体、乳剂注册申报注意事项文章:审评三部 张宁 注册分类五中的特殊情况 5.中国药审中心2004年11月11日两个肿瘤药物脂质体品种的专家咨询会 6.Abra RM, Bankert RB, Chen F, et al. The next generation of liposome delivery systems: recent experience with tμmor-targeted, sterically-stabilized immunoliposomes and active-loading gradients [J]. J Liposome Res, 2002, 12 (1-2): 1-3. 7. Lasic D.D.. Novel applications of liposomes[J]. Trends Biotechnol. 1998, 16(7): 307-321. 8. Mantripragada S. A lipid based depot (DepoFoam technology) for sustained release drug delivery [J]. Prog Lipid Res, 2002, 41(5): 392-406. 9. Swenson CE, Bolcsak LE, Batist G, et al. Pharmacokinetics of doxorubicin administered i.v. as Myocet (TLC D-99;liposome-encapsulated doxorubicin citrate) compared with conventional doxorubicin when given in combination with cyclophosphamide in patients with metastatic breast cancer [J]. Anticancer Drugs, 2003, 14(3): 239-246. 10. Application of Quality by Design (QbD) to Development of Liposomes,王笑笑等人。 本文来自:AVT | 产品分类
重点推荐产品
|
 |